Le mot « pharmacovigilance » est composé de deux parties : « pharmaco » qui signifie médicament et « vigilance » qui est la surveillance.
Par Nesrine KOUYANE
Pour qu’un médicament soit mis sur le marché, il doit passer par plusieurs étapes, la dernière étant des études cliniques (études effectuée sur l’homme) qui prouvent son efficacité et assurent que la balance bénéfice/risque est largement en faveur du bénéfice. Tous les effets indésirables collectés dans le cadre de ces études cliniques sont mentionnés dans la notice.
Les études cliniques sont réalisées sur une population limitée et homogène de patients dans des conditions précises. De ce fait, le médicament pourrait engendrer des effets indésirables qui ne sont pas mentionnés dans la notice et qui pourraient provenir d’un surdosage, d’un mésusage, d’une interaction avec un autre médicament ou un aliment, d’une exposition professionnelle, d’une erreur médicamenteuse ou autre.
L’effet indésirable est une réaction nocive et non voulue détectée, vérifiée, analysée et reliée au traitement. Il peut être mineur tel qu’une toux gênante ou grave tel qu’un décès.
Un manque d’efficacité du traitement ainsi qu’un effet bénéfique inattendu sont considérés comme des effets indésirables.
Dans quel but ?
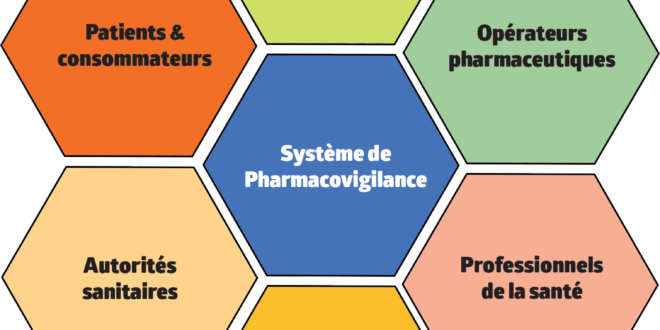
La pharmacovigilance est un système mis en place dans le but d’identifier, d’analyser et de prévenir les effets indésirables résultant de l’utilisation d’un traitement afin d’assurer la sécurité du patient.
Pour que ce système aboutisse à son objectif primaire, il est nécessaire que tous les acteurs de la santé collaborent ensemble dans un esprit de confiance, de partage et de concertation.
Le patient pourrait croire qu’il n’a aucun rôle à jouer dans ce système étant donné que le but est d’assurer sa sécurité. Bien au contraire, le patient est au cœur de la solution. Il est le plus apte à détecter un effet et décrire les conditions ayant amenées à son apparition. Il est donc, le point de départ.
Les effets peuvent être déclarés par le médecin, le pharmacien ou le patient lui-même en utilisant des formulaires adaptés.
Au cours d’un essai clinique, on parle de déclaration d’évènement indésirable et non d’effet indésirable. La différence réside dans le lien de causalité avec le médicament étudié*.
En Algérie, le système de pharmacovigilance est représenté par le centre national de pharmacovigilance et de matériovigilance (CNPM) qui est sous la tutelle du ministère de la santé publique et de la réforme hospitalière (MSPRH).
——————————————————————————————————————————
*l’Effet indésirable est toute réaction nocive et non désirée liée à un médicament, survenant dans les conditions d’utilisation conforme ou non aux termes de l’autorisation ou de l’enregistrement du médicament
L’évènement indésirable désigne toute manifestation nocive et non recherchée chez un participant à un essai clinique, que cette manifestation soit liée ou non à la recherche ou au produit.
L’évènement est considéré comme grave si ce dernier entraine : le décès, la mise en jeu du pronostic vital, l’hospitalisation ou la prolongation d’hospitalisation, l’incapacité ou l’invalidité significative ou permanente, l’anomalie congénitale ou un évènement médicalement important. Dans certains essais cliniques, la grossesse pourrait être considérée comme étant un évènement indésirable grave que le médecin investigateur se doit de déclarer aux autorités.
 Santé News Tout sur la santé en Algérie et ailleurs
Santé News Tout sur la santé en Algérie et ailleurs